
2020年7月30日,国际著名学术期刊《先进功能材料》(Advanced Functional Materials)在线发表了公司天然药物及仿生药物国家重点实验室、药剂学系汪贻广研究团队在抗肿瘤药物递送领域的最新研究成果“pH/Cathepsin B Hierarchical Responsive Nanoconjugates for Enhanced Tumor Penetration and Chemo-Immunotherapy”。

理想的抗肿瘤纳米药物应当可以精准地将活性药物递送至肿瘤细胞内的靶点,从而有效发挥抗肿瘤活性。但是,药物递送过程中的诸多生理性及病理性屏障严重影响了药物的递送效率,极大地限制了药物治疗效能的发挥。肿瘤微环境中较高的组织间隙压、较低的血管通透性、致密的基质及基质细胞是纳米药物进入肿瘤深部的屏障,严重降低了纳米药物对肿瘤深部的有效渗透和分布。此外,纳米药物进入肿瘤细胞后通常会通过内吞-溶酶体途径最终浓集于溶酶体。如何促使纳米药物的肿瘤深部递送进而实现活性药物的高效胞内释放并发挥其治疗效能也是抗肿瘤纳米药物精准胞内递送亟需解决的重要科学问题。
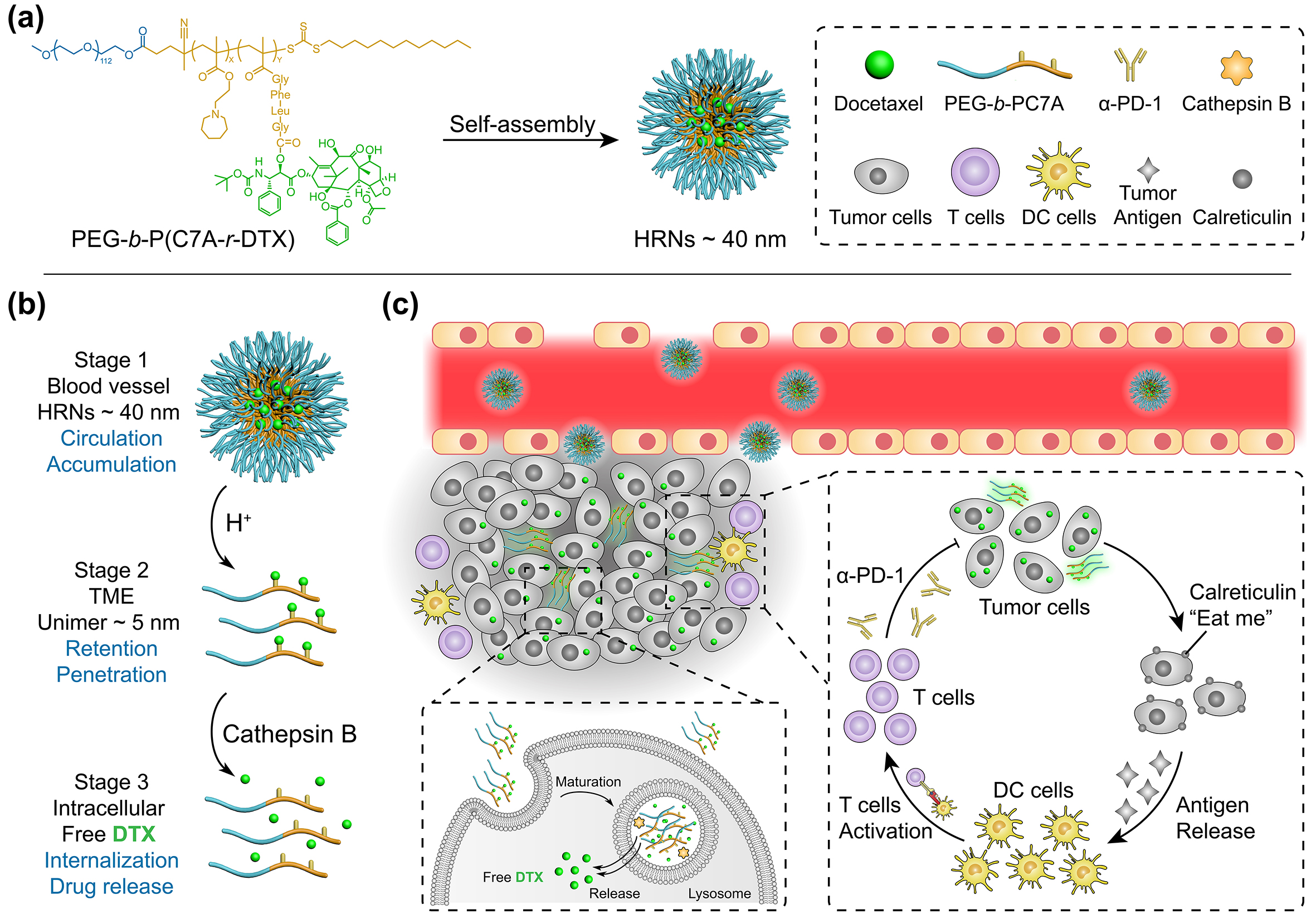
基于以上科学问题,汪贻广研究团队设计并构建了一种结构简单的pH/组织蛋白酶B程序响应的智能纳米药物偶联物(HRNs),通过先后对实体瘤细胞外和细胞内的分子信号进行程序化响应从而克服药物递送过程中的诸多屏障,实现化疗药物多西他赛(DTX)的精准胞内递送。HRNs在血液循环中具有稳定的纳米结构(≈ 40 nm),可以有效地蓄积至肿瘤部位,而肿瘤酸性微环境会触发HRNs纳米结构快速解散,粒径迅速减小(≈ 5 nm)并暴露出正电荷,从而促进药物对肿瘤深部的渗透和摄取。当聚合物-药物偶联物被肿瘤细胞摄取并最终进入溶酶体后,溶酶体中大量存在的组织蛋白酶B会高效裂解DTX分子与聚合物之间的Gly-Phe-Leu-Gly四肽连结键,从而释放活性DTX分子至细胞质中发挥抗肿瘤效应。除了直接发挥肿瘤细胞增殖抑制作用外,HRNs还可以通过诱导肿瘤细胞产生免疫原性死亡,从而激活DC细胞及下游杀伤性T细胞,触发体内抗肿瘤免疫,并解除免疫抑制。联用α-PD-1免疫疗法,HRNs在B16OVA小鼠肿瘤模型中展现出显著的协同抗肿瘤效应。该研究为小分子化疗药物的肿瘤精准胞内递送提供了一个简单、可靠且高效的递送平台技术,并为潜在的临床研究提供了可借鉴的肿瘤化学免疫治疗方案。
该研究获得科技部重点研发计划、国家自然科学基金、中国博士后科学基金等项目资助。集团博雅博士后杜洪亮与六年制员工赵绥为该论文的共同第一作者,汪贻广研究员为该研究论文的通讯作者。
原文链接:https://onlinelibrary.wiley.com/doi/abs/10.1002/adfm.202003757
作者简介

汪贻广,博士,集团研究员、博士生导师,澳门葡萄新京网站药剂学系主任、天然药物及仿生药物国家重点实验室课题组长。主要从事智能纳米药物递送及疾病诊疗研究,取得了一系列创新性成果,以第一作者或通讯作者在Nature Materials、Adv. Mater.、Adv. Funct. Mater.、Nano Letters等国际著名期刊上发表SCI学术论文40余篇。作为负责人获得国家自然科学基金“优秀青年科学基金”、北京市自然基金“杰出青年科学基金”、国家重点研发计划等资助。先后获得2015年中国药学会-中恒青年药剂学奖、2017年中国药学会-赛诺菲青年生物药物奖。目前担任中国药学会药剂学专委会委员、中国药学会纳米药物专委会委员等。
天然药物及仿生药物国家重点实验室、药剂学系
汪贻广课题组 供稿