
2020年张强教授课题组连续在抗肿瘤靶向递送研究领域取得重要成果,目前已在Advanced Functional Materials(IF=16.836)、Journal of Extracellular Vesicles(IF=14.976)、Biomaterials(IF=10.317)等国际权威学术杂志上发表了一系列研究文章。简要回顾如下:
1. 微波合成的纳米共价有机聚合物用于增强光动力治疗
2020年9月9日,国际著名学术期刊《先进功能材料》(Advanced Functional Materials)在线发表了公司药剂学系张强课题组在抗肿瘤药物靶向递送领域的最新研究成果“Strengthened Tumor Photodynamic Therapy Based on a Visible Nanoscale Covalent Organic Polymer Engineered by Microwave Assisted Synthesis”。

近年来,共价有机骨架(COFs)和共价有机聚合物(COPs)由于其较大的表面积、可调的孔径、良好的稳定性和生物可降解性,从而备受关注。本研究采用微波合成法将纳米级COPs的制备时间缩短至20分钟,并构建了包载硫氧还蛋白(Trx-1)抑制剂的药物递送系统(nCOP-PX-12)协同四氨苯基卟啉(TAPP)实现乏氧肿瘤的光动力治疗(PDT)。该“可见”纳米粒被肿瘤细胞摄取并最终进入溶酶体后,C=N连接键会在酸性pH下断裂,释放出游离的TAPP和PX-12。TAPP可以靶向至线粒体,在激光照射下生成活性氧(ROS);同时,PX-12抑制Trx-1使ROS的相对含量增加,诱导肿瘤细胞发生更强烈的免疫原性死亡并刺激抗原提呈细胞的成熟。此外,PX-12能够进一步阻断Trx-1的下游信号通路如HIF-1α和VEGF等,从而影响肿瘤的增殖和转移。在激光照射下,nCOP-PX-12在4T1小鼠模型中展示出显著的抗肿瘤效应,可以有效抑制原位肿瘤、远端肿瘤和肺部转移。该研究为纳米级COPs开发了快速高效的制备方法,展示了其在药物递送应用中的广阔前景,并提出了联合Trx-1抑制的策略来攻克缺氧肿瘤对传统PDT的抵抗性。
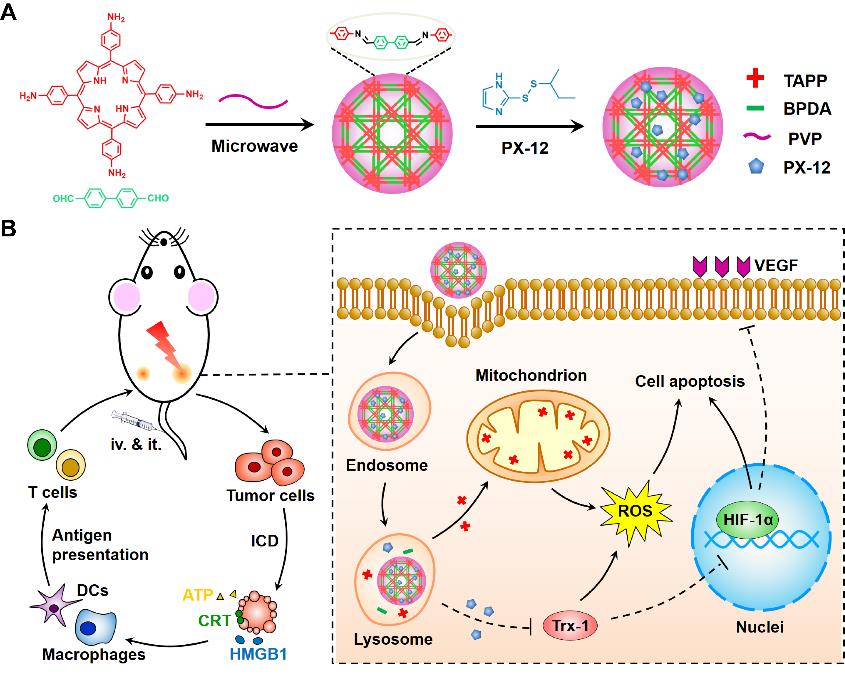
这项工作得到了国家重点研发计划和国家科学基金的支持。澳门葡萄新京网站2017级直博生陆遥为论文第一作者,张强教授和代文兵副教授为共同通讯作者。
原文链接:https://onlinelibrary.wiley.com/doi/10.1002/adfm.202004834
2. 基于细胞外囊泡的抗癌纳米药物的“吃我/别吃我”组合策略
2020年8月19日,国际著名学术期刊《外泌体杂志》(Journal of Extracellular Vesicles)在线发表了公司药剂学系张强课题组在抗肿瘤药物靶向递送领域的最新研究成果“A combined “eat me/don’t eat me” strategy based on extracellular vesicles for anticancer nanomedicine”。

纳米药物面临的一个长期和巨大的挑战是由单核吞噬细胞系统(MPS)介导的对其大量摄取和快速清除,这极大地阻碍了纳米药物的发展。该研究构建了“eat me / don’t eat me” 联合策略,以实现MPS逃逸和高效药物递送。方法上,使用源自DC2.4细胞的阳离子化甘露聚糖修饰的胞外囊泡饱和MPS (eat me)。然后,纳米载体与来自人血清的富含CD47的外泌体融合,以逃避MPS的吞噬作用(don 't eat me)。纳米载体还装载抗肿瘤药物,并与之前使用的归巢肽(c(RGDm7))结合,以促进肿瘤组织聚集和癌细胞摄取(eat me)。这一概念在体外得到证实,巨噬细胞的内吞作用减少,肿瘤细胞摄取增强,而在体内循环时间延长,肿瘤累积增加。特别是,与传统的纳米载体相比,该策略增加了在肿瘤组织的分布。这项研究不仅揭示了克服吞噬逃逸的挑战,而且为显著改善治疗效果提供了一种策略,有助于实现通过靶向纳米药物进行主动药物递送。
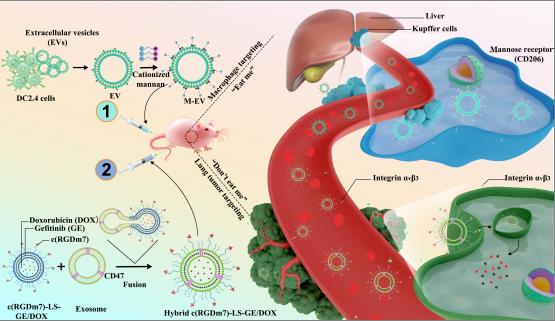
澳门葡萄新京网站(中国)集团有限公司天然药物及仿生药物国家重点实验室的王静博士为本文的表面等离振子共振实验提供了帮助。澳门葡萄新京网站博士后扎琪亚为论文第一作者,张强教授和代文兵副教授为共同通讯作者。
原文链接:https://www.tandfonline.com/doi/full/10.1080/20013078.2020.1806444
3. 负载siRNA纳米盘上的各向异性配体通过调节纳米-生物互作产生独特抑癌作用
2020年4月3日,国际著名学术期刊《生物材料》(Biomaterials)在线发表了公司药剂学系张强课题组在抗肿瘤药物靶向递送领域的最新研究成果“Anisotropic active ligandations in siRNA-Loaded hybrid nanodiscs lead to distinct carcinostatic outcomes by regulating nano-bio interactions”。

主动靶向是提高纳米药物的递送效率和治疗功效的最重要策略之一。目前仍不了解各向异性配体修饰如何影响纳米-生物相互作用以及纳米药物的治疗效果。为了揭示各向异性配体修饰对纳米药物传递作用机制的影响,本研究制备了一系列阳离子纳米盘(NDs),并对其边缘(E)或平面(P)进行cRGD修饰,获得了各向异性靶向纳米盘(分别记为E-cRGD-NDs和P-cRGD-NDs)并阐明了两种各向异性靶向NDs之间的区别、相似性和作用机制。研究发现E-cRGD-NDs在siRNA负载、细胞摄取、沉默效率、蛋白表达甚至体内效应等方面显示出明显的优势,这些差异和相似性与配体修饰的各向异性密切相关。同时,cRGD有效地分离了靶向区域和siRNA负载域,从而最大限度地发挥了各自的功能。此外,由于表面包裹了硅氧硅网格结构,新型靶向杂化阳离子纳米盘非常稳定,在体内外药物递送和治疗中显示了明显的优势。这些发现反映了配体各向异性的独特作用,也为广泛筛选靶向纳米药物提供了新的策略。
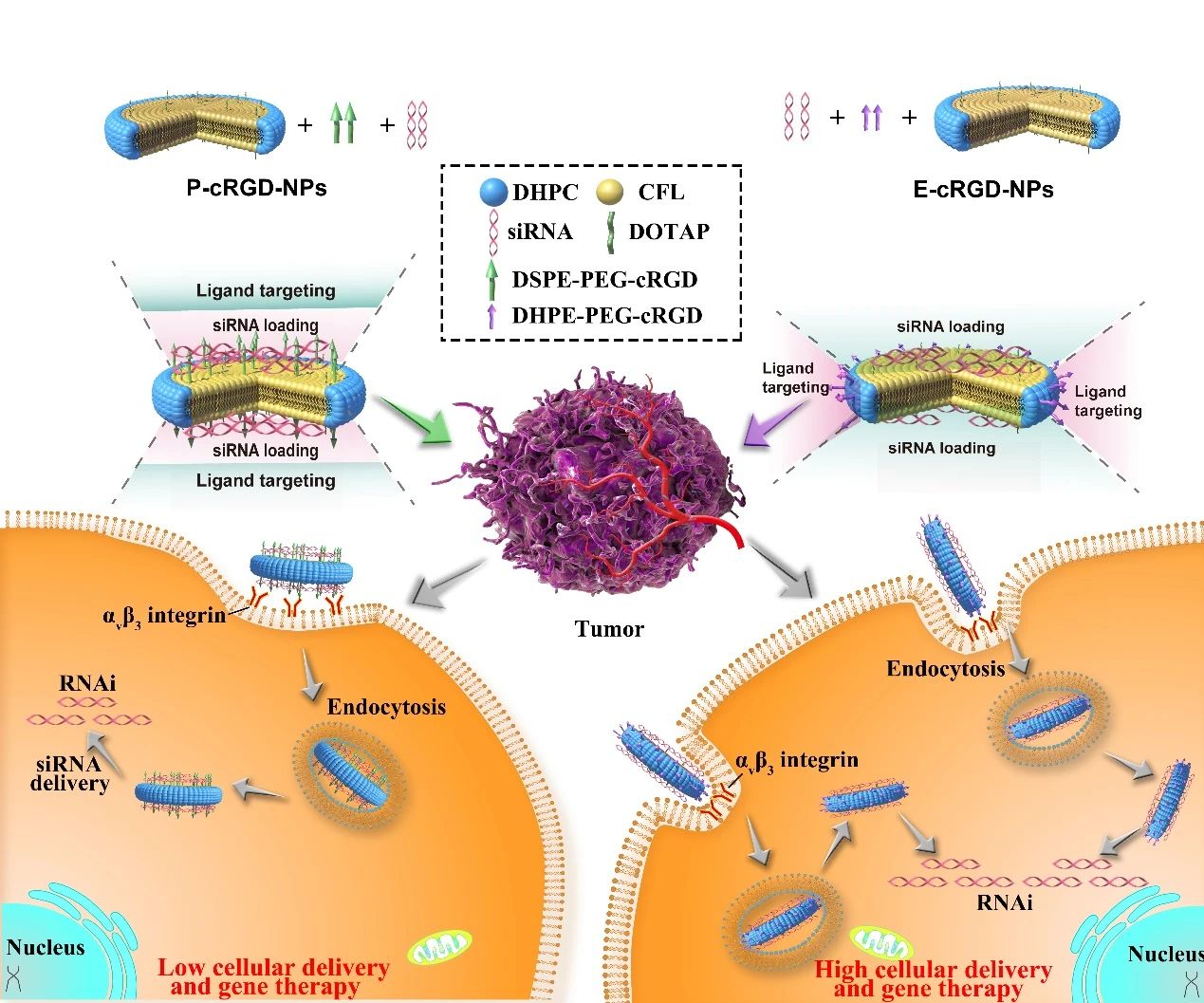
这项工作得到了国家基础研究计划、国家重点研发计划和国家自然科学基金的支持。澳门葡萄新京网站2016级博士生陈晴为论文第一作者,澳门葡萄新京网站(中国)集团有限公司何冰、张强以及沈阳药科大学陈大为共同通讯作者。
原文链接:https://doi.org/10.1016/j.biomaterials.2020.120008
【作者简介】

澳门葡萄新京网站(中国)集团有限公司张强教授系集团特聘教授,分子药剂学与释药系统北京市重点实验室主任,教育部创新团队负责人,中国药学会(CPA)常务理事,中国药学会纳米药物专业委员会副主任委员,国家药典委药制专业委员会副主任,《药学学报B》副主编,《J Control Release》编委等。作为CRS中国分会的首任主席,长期从事纳米药物研究,在Nature Communications,Advanced Functional Materials、ACS Nano、Nano Letters、Advanced Drug Delivery Review, Biomaterials, J Control Release等发表300多篇SCI论文。负责完成创新制剂研究30余项,申请国内外发明专利50多项,开发上市多个新型释药系统,产生重大经济与社会效益。获国家与省部级科技成果奖多项。
药剂学系
张强课题组 供稿